legături chimice de metal, lecții de la distanță
V-ați întrebat vreodată - există un singur atom de metal în natură?
Metal există întotdeauna sub forma unui cristal. Bineînțeles, acest lucru se datorează unei anumite structuri și necesită anumite proprietăți fizice și chimice.
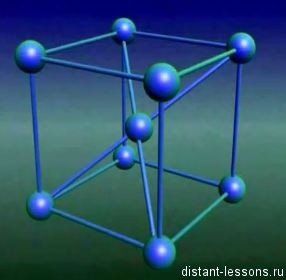
Să ne imaginăm că avem o bucată de metal. De exemplu, sunt date de fier (Fe). Ce este în această bucată de fier?
Se compune din atomi de fier, care sunt în ordinea corectă - în rețeaua cristalină.
In atomul de fier ca orice metal pe stratul superior al numărului mic electronice de electroni, plus o rază atomică mare. Pe acest ultim strat electronii sunt suficient de scăzute.
Orice metal capabil de a da electroni, devenind un ion încărcat pozitiv.
În exemplul de fier:
În cazul în care pentru a trimite particulele încărcate negativ separate - electroni? Mai puțin este întotdeauna atras de pozitiv. Electronii sunt atrași de celălalt ion (încărcat pozitiv) de fier în rețeaua cristalină:
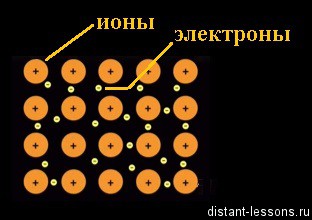
Ion devine atom neutru.
Și acest proces se repetă de mai multe ori.
Se pare că, electronii liberi de fier sunt în mișcare constantă pe întregul volum al cristalului, de rupere și unește ionii în nodurile cu zăbrele. Un alt nume pentru acest fenomen - un nor de electroni delocalizat. Termenul „delocalizat“ este - gratuit, nu este legat.
Acest lucru este fixat rigid în ionii de metal cristal cu zăbrele și circula liber pe electronii de cristal.
În unele legături chimice de metal este similar cu ion - ioni (cationi) sunt de asemenea prezente în ea. Cu toate acestea, o diferență semnificativă este aceea că:
- acolo cationi (particule încărcate pozitiv) și anionii în legăturile ionice (ioni încărcați negativ);
- există cationi și electroni în legătură chimică din metal.
În ceva ca o legătură covalentă chimică de metal și - are, de asemenea electroni comune, dar:
- în covalente electroni de legare chimică sunt împărtășite de două elemente (localizate între ele);
- in metal - ele aparțin absolut toate ionii.
legătură chimică a metalelor - legătura între E cristalele pozitive ion de metale efectuate datorită atracției de electroni care se deplasează liber în cristal.
Pentru a atinge starea de o moleculă de metal poate doar la temperaturi foarte ridicate, - atunci când din metal merge într-o stare gazoasă.
Proprietățile fizice ale legăturii chimice de metal:

- conductivitate termică (particule de transfer de căldură - în acest caz - electroni);
- conductivitate electrică;
- toate substanțele - solide (cu excepția unor metale alcaline);
- puncte de topire ridicate și cu punct de fierbere;
- un luciu metalic caracteristic - apare din cauza reflexia razelor de către electroni; în cazul roda de metal pulbere, luciu metalic este pierdut - nici un grilaj - nici electroni mers liber;
- Substanțe de înaltă densitate (altele decât metalele alcaline);
- plasticitate - această deplasare a straturilor de cristal cu zăbrele.