Aminoacid - o componenta de proteine - salut elev!
Aminoacid - o componentă a proteinelor
Metodele pentru izolarea proteinelor din aminoacizi
Compoziția de proteine include aminoacizi, care pot fi izolați prin hidroliză (acid sau alcalin) sau prin acțiunea enzimelor proteolitice.
Hidroliza acidă a proteinei este realizată prin fierbere cu soluții puternice de acid clorhidric sau sulfuric timp de 10-20 h. Acest procedeu de preparare a unui amestec de proteine de aminoacizi este relativ simplu, dar are un dezavantaj semnificativ. Într-o astfel de hidroliză, un impurități întotdeauna alți compuși organici, în special carbohidrați care conțin proteine naturale, un amestec de produși secundari care leagă brun porțiune a eliberat aminoacizi din proteine. În plus, hidroliza acidă nu se poate izola complet aminoacidul triptofan, deoarece acesta este distrus.
Descompunere la alcaline porțiune de proteină L-amino acizi procedează într-un D-aminoacid (vezi stereoizomerie de aminoacizi. P. 16), iar unele dintre ele sunt distruse. Cel mai adesea, această metodă de hidroliză este utilizată pentru a produce triptofan dintr-o proteină, care nu poate fi obținut prin hidroliza acidă.
Proteinele pot fi hidrolizat la o temperatură optimă, cu enzime - peptidaze. Aminoacidul nu este distrus, ci pentru a efectua o hidroliză completă și scinda toți aminoacizii în formă liberă nu este posibilă.
Dacă hidroliza pentru a lua proteinele din organisme vii, atât de origine animală și vegetală, precum și proteine ale diferitelor organe și țesuturi, este încă un amestec de aminoacizi identici. Se pare că în hidrolizate de orice proteine găsite
numai douăzeci de aminoacizi, dar fiecare dintre ele pot fi găsite într-o singură proteină de mai multe ori în diferite părți ale macromoleculei.
proprietăți ale aminoacizilor
În plus față de aminoacizi în structura proteinelor, cunoscut mai mult de o sută de aminoacizi, care se găsesc în individuale peptide, hormoni, antibiotice, sau pur și simplu sunt în stare liberă. De exemplu, un-aminopropionic (a-alanină) - este unul dintre cei douăzeci de „aminoacizi proteine“ in-aminopropionic (a-alanină) este absentă în proteine, dar se găsește în plante și celule de animale, în forma sa liberă:
Acești aminoacizi diferă în locul amino aranjament: unul este situat în poziția alfa față de gruparea carboxil în celălalt - în poziția.
Se observă că compoziția proteinelor constă numai dintr-un-aminoacizi. Principalele grupe funcționale ale acestora sunt
capabil de disociere. Când dizolvat proteine sau aminoacizi individuali în apă formează un caracter acid sau bazic soluție. Acest fapt se explică prin faptul că proteinele pot conține aminoacizi precum aspartic și glutamic având două grupări COOH. Apoi, proteina devine proprietăți acide. In alte proteine este dominată de arginină, lizină sau histidină având doi NH2-grup, care informează proprietățile de bază ale proteinelor.
Într-un domeniu larg de pH există predominant aminoacizi în formă de ioni dissotsiirovannoi bipolare ca molecula cu o grupare carboxil și o grupare amino protonate:
Pentru acizii-un amino care formează proteine, este caracteristic de izomeri optici. Activitatea optică a substanțelor organice din cauza lipsei unui centru de simetrie în moleculă. Pentru a identifica astfel de compuși pot, în cazul în care determina dacă o moleculă dintr-un atom de carbon asimetric, adică cele patru valențele care sunt saturate de diverși radicali ..:
Dacă în exemplul de mai sus, în locul radicalului livra un atom de hidrogen, se obține aminoacidul glicină:
În această moleculă de aminoacizi la valențele de carbon sunt ocupate de doi atomi identici - hidrogen și, prin urmare, atomul de carbon nu va fi acum asimetric. Intr-adevar, glicina - doar unul dintre aminoacizii naturali, care nu are nici o activitate optică. Activitatea optică poate detecta dacă fasciculul de lumină directă polarizată la o soluție de aminoacizi: dacă fasciculul este deviat spre dreapta, aminoacidul indicat de marcajul (+) în cazul în stânga - semnul (-). Alte proprietăți fizice și chimice ale izomerilor optici ai acestora.
izomerii stereochimici ai aminoacizilor, în contrast cu izomerii optici discutate mai sus reprezintă literele L sau D.
Când un atom de carbon asimetric, gruparea amino este pe dreapta, este D-aminoacid, dacă este lăsat - L-amino acid:
Acizii Numai o-L-amino gasite in proteine animale. Ele sunt numite naturale. Cantități mici de D-aminoacizi se găsesc numai în microorganisme. D-aminoacizi nu sunt digerate de animale și plante, care nu au enzime care pot cataliza conversia compușilor D-series.
Compoziția aminoacizilor
Aminoacizii pot fi grupate în funcție de caracteristicile structurii lor. Lista de aminoacizi de bază.
Monoamshomonokarbonovye au un amino și unul grupări kaoboksilnuyu în moleculă:
Glicina nu are nici un atom de carbon asimetric, un derivat de amină optic inactiv este acidul acetic.
O structură similară la alanină aminoacizi:
Prezența grupării OH serină crește reactivitatea. Liberă gruparea OH a serinei în compoziția unei proteine poate crește reactivitatea moleculei de proteină:
Prezența SH-grupuri cisteină oferă proprietăți speciale:
Dintre cele două molecule de cisteină pot forma noi aminoacizi - cistina. grupări sulfhidril cisteinice în același timp, se transformă în punte cistină disulfură:
Sulful se găsește într-un alt important pentru metabolismul aminoacizilor:
La aminoacidul treonină următoarea structură moleculară:
Derivat al acidului izovalerianic este valina:
Derivații acidului hexanoic sunt leucina și izoleucina:
Acizii Monoaminodikarbonovye sunt acide în natură, și ca parte a moleculei proteice conferi caracter acid datorită disocierea libere de proteine grupările carboxil:
aminoacizii Diaminomonocarboxylic conțin o grupă carboxil a două grupări amino:
In unele proteine gasite derivat hidroxil a aminoacizilor:
Un important kislotoi diaminomonokarbonovoi este arginină:
Includerea lizinei proteine, arginina sau hidroxi-lizina dă proprietăți alcaline.
Dintre aminoacizii care fac proteine, este un astfel de radical care includ structuri ciclice. De exemplu, în cazul în care un hidrogen înlocuit cu alanină în radicalul fenil, se obține aminoacidul fenilalanina:
Și structural și funcțional apropiat fenilalanină alt aminoacid - tirozina:
Alt radical ciclic are aminoacidul triptofan:
Următorul aminoacid - histidină - este alcalin, deoarece conține două grupe principale, și anume, -NH2 și = NH: ..
Doi sau mai mulți aminoacizi au fost găsite în proteine, cu toate că acestea nu sunt în mod legitim să fie destul de numite aminoacizi. Ele nu conțin o grupare amino -NH2, și grupa imino = NH:
Hidroxiprolina și hidroxilizina sunt mai frecvente in proteine, izolat din țesutul conjunctiv, cum ar fi colagen.
Recent, au existat rapoarte despre descoperirea de noi proteine în - douăzeci și primul - aminoacizi - aminolimonnoy:
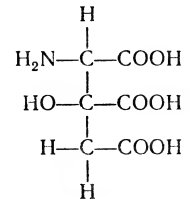
Dintre ceilalți aminoacizi găsiți în proteine, se distinge prin prezența a trei grupări carboxil, o sarcină negativă ridicată. A fost descoperit în diferite țesuturi umane, animale și unele bacterii. Despre funcția acestui aminoacid nu este cunoscută încă.
La fel cum este puțin cunoscută, și încă unul - al douăzeci și doilea, deschis recent în ribozomii de aminoacizi - karboksiasparaginovoy:
moleculele sale au, de asemenea, o sarcină negativă neobișnuit de mare.
Descărcați hârtia: Nu trebuie să descărcați fișierele de pe serverul nostru ca DESCĂRCAREA aici
Parola pentru arhiva: privetstudent.com