Boltzmann

Boltsman Lyudvig (1844-1906) - marele fizician austriac și unul dintre fondatorii teoriei moleculare-cinetice. În scrierile lui Boltzmann teoria moleculara-cinetică pentru prima dată a apărut ca o bună funcționare, teorie fizică coerentă. Boltzmann a dat o interpretare statistică a doua lege a termodinamicii. Ei au făcut foarte mult pentru dezvoltarea și promovarea câmpului electromagnetic al teoriei lui Maxwell. Un luptător prin natura, Boltzmann a apărat cu pasiune necesitatea unei interpretări moleculare a fenomenelor termice și a luat greul doctrinei luptă care neagă existența moleculelor.
În ecuația (4.5.3) intră raport constant de gaz universal la constanta lui Avogadro NA R. Acest raport este aceeași pentru toate substanțele. Se numește constanta Boltzmann, în onoarea lui Boltzmann, unul dintre fondatorii teoriei moleculare-cinetice.
constanta lui Boltzmann este:
Ecuația (4.5.3) cu constanta Boltzmann este scris după cum urmează:
Sensul fizic al constantei Boltzmann
Punct de vedere istoric, temperatura a fost introdus mai întâi o cantitate termodinamic și unitatea de măsură a fost stabilită pentru ea - grade (vezi § 3.2.). După stabilirea comunicării cu temperatura medie a energiei cinetice a moleculelor devine evident faptul că temperatura poate fi definită ca energia cinetică medie a moleculelor și exprimă-l în jouli sau jouli, m. F. Valorile T în schimb introduceți valoarea T *, astfel încât
Astfel, temperatura determinată legată de temperatura, exprimată în grade, după cum urmează:
De aceea Boltzmann valoare constantă poate fi considerată ca legătura între temperatură, exprimată în unități de energie, o temperatură, exprimată în grade.
dependența de presiune a gazului de concentrația și temperatura moleculelor
Exprimându-E din (4.5.5) și înlocuind în formula (4.4.10), obținem o expresie care arată dependența de presiune a gazului din concentrația și temperatura moleculelor:
Formula (4.5.6), rezultă că, în aceleași presiuni și temperaturi din concentrația moleculelor de gaze este același.
Prin urmare, legea lui Avogadro: volume egale de gaze, la temperaturi și presiuni identice, același număr de molecule.
Energia cinetică medie a mișcării de translație a moleculelor este direct proporțională cu temperatura absolută. Coeficientul de proporționalitate - Boltsmanak constantă = 10 -23 J / K - să-și amintească.
§ 4.6. distribuție Maxwell
În multe cazuri, cunoașterea unor valori medii ale mărimilor fizice nu este suficient. De exemplu, cunoașterea planului mediu de creștere uman nu permite eliberarea de îmbrăcăminte în diverse dimensiuni. Trebuie să știm numărul aproximativ de persoane, creșterea care este într-un anumit interval. În mod similar, este important să se cunoască numărul de molecule care au o viteză diferită de media. Maxwell a găsit în primul rând, aceste numere pot fi determinate.
Probabilitatea unui eveniment aleator
În §4.1 am menționat că pentru a descrie comportamentul unei populații mari de molecule J. Maxwell a introdus conceptul de probabilitate.
Așa cum a fost subliniat, în principiu, imposibil de a urmări variația vitezei de circulație (sau impuls) a unei singure molecule pe o perioadă lungă de timp. De asemenea, nu se poate determina cu exactitate viteza moleculelor de gaz la un moment dat. Din mediul macroscopic, în care gazul este (o anumită cantitate și temperatură), nu apar cu necesitatea de anumite valori ale vitezelor moleculare. molecula de viteză poate fi considerată ca o variabilă aleatoare, în care datele de condițiile macroscopice pot lua valori diferite, la fel ca orice număr de puncte, de la 1 la 6 (numărul de fețe este de șase oase) pot cădea în aruncarea zaruri. Prezice câte puncte se încadrează în această zaruri aruncat, nu poți. Dar probabilitatea ca toamna, spun, cinci puncte pentru a determina.
Care este probabilitatea ca un eveniment aleator? Să-l a produs un număr foarte mare de teste N (N - numărul de zaruri aruncă). În acest caz, cazurile N“au avut loc procese rezultate favorabile (m. E. Pierderea cinci). Apoi, probabilitatea acestui eveniment este raportul dintre numărul de cazuri cu un rezultat favorabil pentru numărul de teste cu condiția ca acest număr cât mai multe mare:
Pentru oase simetrice probabilitate de orice număr selectat de puncte la 1 la 6 egal
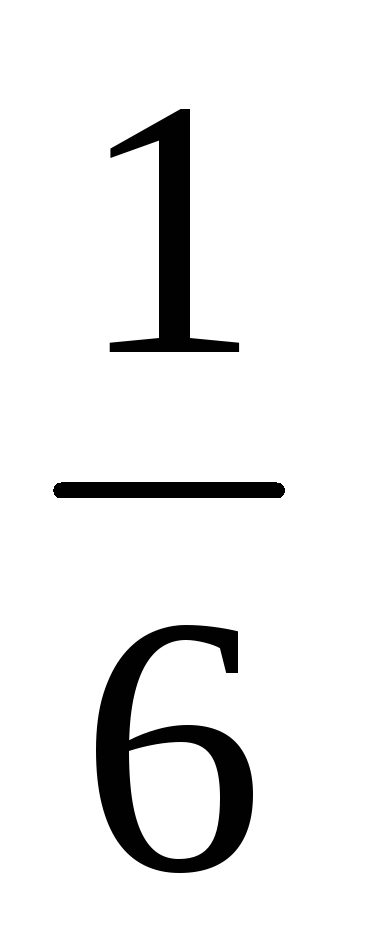
Vedem că un anumit model cantitativ este detectat pe fundalul unui set de evenimente aleatoare, apare numărul. Acest număr - probabilitatea - vă permite să se calculeze medii. Deci, dacă faci 300 aruncă oasele, numărul mediu de cădere din cele cinci, după cum rezultă din formula (4.6.1), va fi egală cu: 300 ·
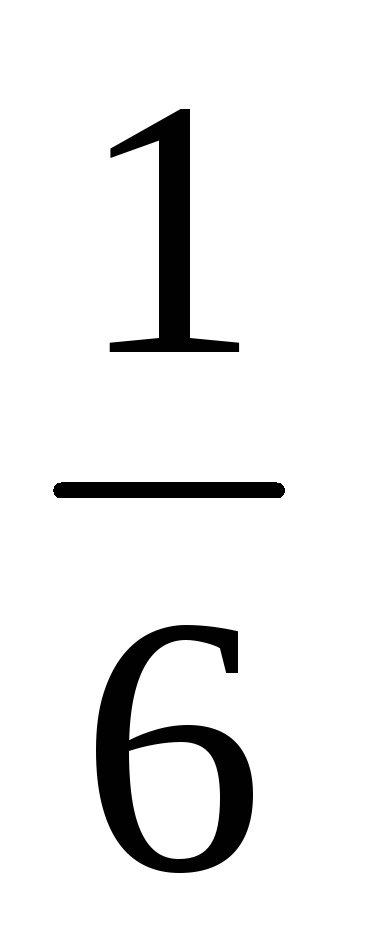
Nu există nici o îndoială că comportamentul moleculelor de gaz din vasul este de zaruri mult mai complicate mișcare aruncate. Dar vă puteți aștepta să găsească unele legi cantitative care permit să se calculeze media statistică, în cazul în care numai pentru a pune problema, cât și în teoria jocurilor, și nu ca în mecanica clasică. Este necesar să se renunțe la problema nerezolvată de a determina valoarea exactă a vitezei moleculei la momentul și să încerce să găsească probabilitatea ca rata este de o anumită importanță.